极高湿环境下潮湿的土遗址表面形成的水膜抑制霉菌生长
摘要:
霉菌生长是潮湿地区土遗址劣化的常见病害之一。研究表明,环境相对湿度低于75%时霉菌难以生长,高于75%时,随着湿度增加,霉菌也开始生长与繁殖。然而,目前霉菌在极高湿条件下生长特性尚不明晰。在先前的研究中,我们使用温州谯楼土遗址的样本来评估自然通风和照明模式对霉菌生长的影响。本研究在此基础上进一步实验,评估在不同相对湿度和照明模式条件下的霉菌生长。实验结果表明,三种相对湿度条件对霉菌生长的影响各不相同。与有利于霉菌生长的相对湿度范围(94%-99%)相比,极高湿环境中(大于99.9%)的霉菌生长被显著地抑制。使用显微镜观察发现了样品表面水膜的存在,这层水膜可能通过隔绝氧气的方式抑制了霉菌的生长。本文研究了极高湿环境中霉菌生长特征,将为高湿环境中土遗址的霉菌控制方法提供更多可能。
1. 介绍
考古现场、土遗址和古墓葬等建筑遗产很容易遭到微生物病害的侵扰,导致艺术价值和历史价值受到减损甚至破坏,比如法国拉斯科洞窟[1][2]和日本的高松冢[3][4]。这是因为大部分遗产是岩石、夯土、砖等多孔材料构成的,微生物的菌丝和着色剂渗入这些材料微孔中[5][6],造成材料表面不可逆的污染[7][8]。此外,生物风化往往还伴随着化学和物理风化[9][10],从而对遗产造成更大的破坏。微生物的代谢产物会“溶解”建筑材料[11][12]、扩大和改变原有的孔隙体积和结构[7][13],造成材料渗透性、水分含量和保水率的改变[14]。微生物群落还会在材料表面形成生物膜,影响表面的水分含量[15][16],或者通过生物矿化作用参与盐结晶过程[17][18],进而增加冻融破坏、粉化脱落等劣化风险[19][20]。
为了减少微生物劣化带给建筑遗产的不利影响,全面掌握其生长特性就显得非常必要。已有的研究表明,微生物劣化是多种因素共同作用的结果[21]。首先,微生物孢子无处不在[22],而粗糙材料表面易于孢子的吸附,如果条件适宜,孢子就会被激活并进一步繁殖。一般来说,微生物在0至50℃的温度范围内都能够生长,不过多数微生物在25℃左右的条件下繁殖达到峰值[23][24]。当相对湿度超过75%后就会极大地促进它们生长[25]。Smith和Hill[26]关于两种霉菌在不同温度和相对湿度条件下的生长实验结果清楚地展示了它们的生长特性(图1)。营养物质也是微生物生长所必需的[27],一般情况下建筑物表面或风化材料上的沉积物即可满足微生物营养需求。此外,还有研究发现微生物的繁殖与可见光也存在一定联系,比如光养微生物可以利用不同波段的光来获得能量[28]。不同的光源对微生物的生长影响也不同,我们的研究表明,在潮湿夯土表面,霉菌的生长情况在自然光中大于在人造光大于在黑暗条件下[29]。
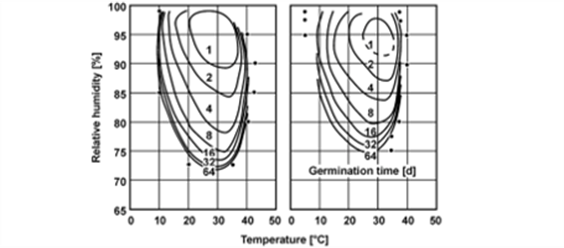
图1. (左)限制曲霉和(右)杂色曲霉的孢子等值线(发芽时间和生长速率)[26]
然而,在极高的湿度条件下霉菌的生长机制研究仍然非常有限[30-34]。有研究表明,由于缺乏溶解的营养,真菌不能在纯净水(水活度aw=1)中生长[35][36]。但对于其他材料,霉菌在aw=1条件(相对湿度接近100%)下的生长情况还没有明确结论,从而使类似图1的等值线图在相对湿度接近100%的区域出现缺失。
此外,在中国南方地下水位较浅的地区,由于遗址本体直接与地面相接,地下水会不断提供水分供给,导致遗址本体表面长期维持较高的含水量,增加了生物劣化的风险。考虑到实际项目中的土遗址及其保护设施中,空气温度通常在15至25℃范围内,因此在本文中,我们重点关注室温在25℃左右,且湿度非常高的展览环境对建筑遗产生物劣化的影响。
我们进行了两组实验以观测在极高湿度(大于99.9%)下微生物的生长,另外四组实验在高湿度(74%-92%,94%-99%)下比较微生物生长差异。同时,因为在展览空间中必须使用光,我们在实验中也设置了照明的条件。
2. 材料和方法
2.1 实验材料和条件
实验采用温州谯楼土遗址的土壤(表1),其主要成分是粘土。将样品的初始水分含量设置为0.30至0.35kg/kg(初始饱和度70%-85%)。实验划分了三个相对湿度区间和两种光照环境,共6组(每组4个样品)分别放在6个干燥器中。将这些干燥器放置于空调控制的实验室中进行56天(8周)的实验。干燥器中的温度、通风条件和实验室中的空气速度保持恒定,如表2所示。
需要说明的是,中国南方地区的地下水位较浅,土遗址受地下水的持续水分供给,其表面及附近总是处于高湿的状态并保持一定的高含水量。因此本实验将所有样品的初始含水量设置为较高水平,以此还原高湿环境中的土遗址状态。
表1. 土壤样本信息
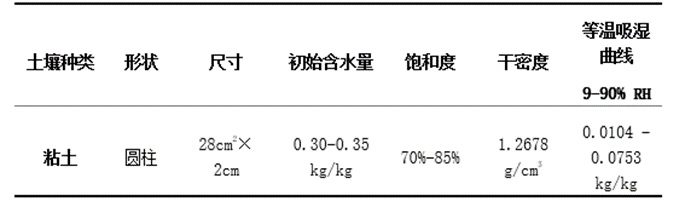
表2. 六组干燥器的实验条件
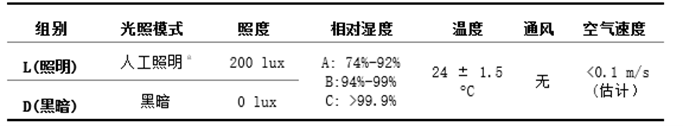
a照明模式:实验室中六个相同OSRAML18W/765YZ18RR1510。RH:相对湿度。
在实验中,使用三种不同的饱和盐溶液(NaCl饱和盐溶液、KNO3饱和盐溶液和纯水)来维持不同相对湿度环境(图2)。在盐溶液和样品较高初始含水量(接近0.35kg/kg)的共同作用下,在干燥器中产生三种不同的湿度状态:相对湿度在74%-92%(A)、94%-99%(B)和大于99.9%(C),如图3所示。
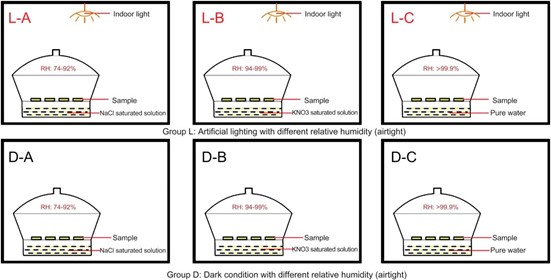
图2. 实验室中六个条件的示意图
*平衡状态下饱和溶液的相对湿度参考ISO12571:2013。(NaCl:75.29%-0.12%;KNO3:93.58%-0.55%在25°C下)
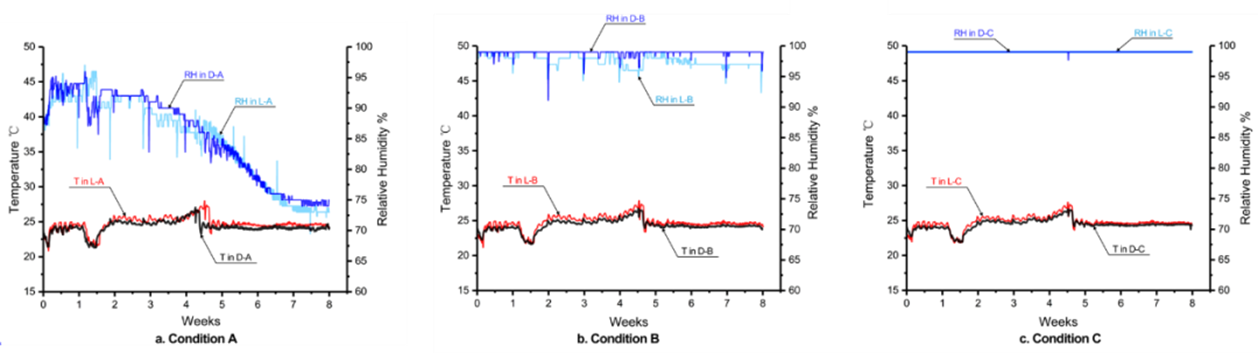
图3. 光照组和黑暗组在相对空气湿度(RH)在74%—92%,94%—99%和大于99.9%时下的温度和相对湿度
2.2 霉菌生长评估指标
本研究使用霉菌生长等级(Mold Growth Grade)和霉菌生长面积比(Mold Growth Area Ratio)作为评估霉菌生长水平的指标[37]。霉菌生长等级(MGG)表示霉菌的生长水平,评估标准列于表3。霉菌生长面积比(MGAR)是100倍放大显微镜下的整个观察区域内霉菌面积占显微镜观察视野的比率。
表3. 霉菌生长等级的评估标准[48]

3. 结果
3.1. 在不同的相对湿度条件下霉菌的生长
图4比较了光照组和黑暗组中相对湿度分别为74%-92%区间,94%-99%区间以及大于99.9%区间时霉菌生长的评估情况。
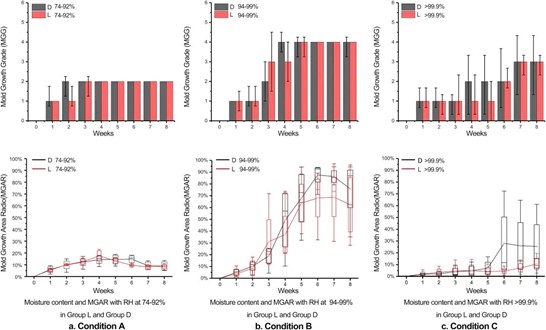
图4. 光照组和黑暗组之间的霉菌生长面积比MGAR和MGG的比较
A:环境相对湿度在74%-92%范围内:如图4a所示,前四周因为环境湿度较高,霉菌出现了一定程度的生长,但霉菌生长等级均不超过2级。四周后环境湿度开始下降(如图3a),霉菌的生长出现明显的衰减。两组的霉菌生长均温和,并且随着相对湿度的持续下降,霉菌生长面积比开始下降。
B:环境相对湿度在94%-99%范围内:图4b显示,光照和黑暗两组的霉菌生长面积比均显著增加,并分别在第7和第6周达到峰值,随后霉菌的生长略有缓和。两组的霉菌生长等级均达到了第四级,这意味着该状态下霉菌生命力较为“旺盛”,生长情况基本可以被肉眼观察到。
C:环境相对湿度大于99.9%范围内:图4c表明,光照和黑暗两组的平均霉菌生长面积比增长极为缓慢,其中光照组的在实验期间始终保持在20%以下,黑暗组在前五周与光照组相似,从第六周起出现了较明显的增长。两组的霉菌生长等级均经历了从一级逐级升高至三级的过程,但黑暗组比光照组提前两周进入二级。
3.2. 霉菌生长与含水量之间的关系
图5比较了光照组和黑暗组中相对湿度分别为74%-92%区间,94%-99%区间和大于99.9%区间时的霉菌的生长和样品含水量变化情况。由于样品的初始含水量设定在相同的较高水平,因此含水量持续降低。
A:环境相对湿度在74%-92%范围内:图5a显示,在最初的6周中,两组样品的含水量均显著下降。然后,含水量变化放缓。这与干燥器中的相对湿度变化趋势是一致的。在该环境中,随着空气湿度的降低(图3a)和土壤样品的连续干燥(图5a),霉菌生长受到抑制。
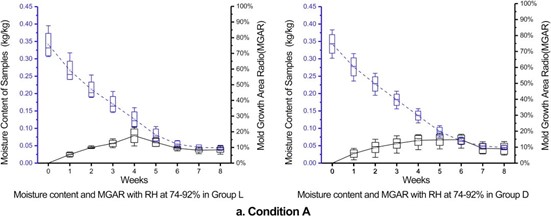
图5a. 条件A(RH=74%-92%)下光照组和黑暗组的霉菌生长面积比和水分含量的比较
B:环境相对湿度在94%-99%范围内:如图5b所示,由于处于更高的相对湿度环境中,两组样品的含水量减少速度更为缓慢。在第三周左右,霉菌生长面积比呈现显著增长。从第五周和第六周开始,两组的霉菌生长面积比分别出现了增速放缓甚至减小的现象,并在随后的实验中进一步下降。
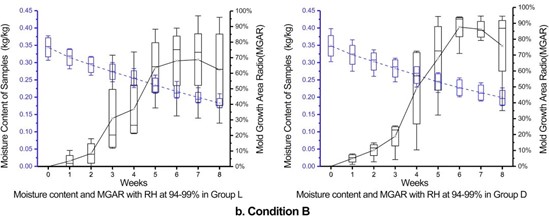
图5b. 条件B(RH=94%-99%)下光照组和黑暗组的霉菌生长面积比和水分含量的比较
C:环境相对湿度大于99.9%:如图5c所示,样品始终保持着较高的含水量。在该条件下,样品水分含量下降速度是三个适度环境中最慢的,样品含水量始终高于0.27kg/kg。相应地,霉菌的生长面积比也维持在较低水平,比相对湿度在94%-99%环境低得多,基本与74%-92%相对湿度的环境相同。其中光照组的生长面积比始终保持在20%以下,黑暗组从第六周开始上升,并达到较高水平,这其中的原因将在第四节中详细讨论。
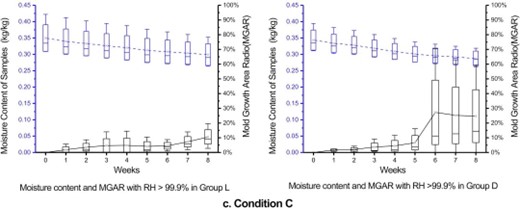
图5c. 条件C(相对湿度大于99%)下光照组和黑暗组的霉菌生长面积比和水分含量的比较
3.3. 材料表面特性
为了确定实验中样品的表面特性,我们做了补充实验来进一步观察,所有设置与先前的霉菌实验一致。此处展示了在实验开始时和五周后的显微镜图像(图6)。在相对湿度大于99%环境中可以清晰地观察到附着在样品表面的水膜。由于表面的粗糙度不同,水膜的分布和厚度也不均匀,凹陷处积聚了更多的液态水,说明样品表面的粗糙度会影响水膜的存续。在相对湿度在94%-99%的环境中,放大200倍观察到样品表面潮湿,但无水膜。在相对湿度在74%-92%的环境中,样品比其他条件下更干燥,并在样品表面观察到了裂纹。
4. 讨论
整体来看,不同的照明条件(人工照明/黑暗)情况,霉菌生长速度和等级无大的差异。本实验来看,霉菌繁殖的速度与环境的相对湿度密切相关。
因此,我们绘制了图7以更清晰地比较不同相对湿度环境中霉菌生长的情况。
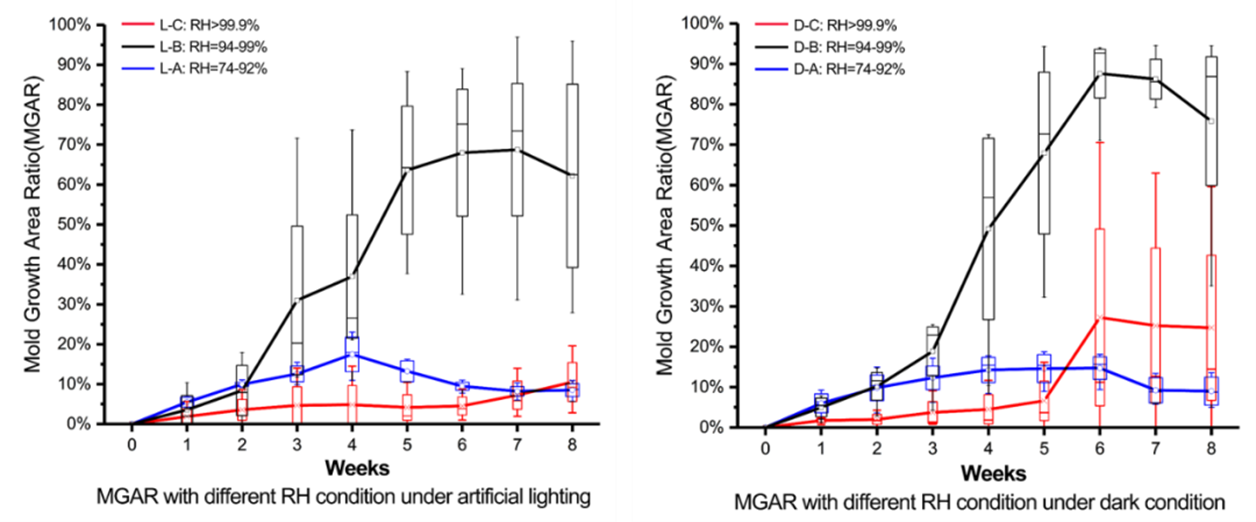
图7. 光照组和黑暗组在相对湿度为74%-92%区间,94%-99%区间以及大于99.9%区间时的霉菌生长面积比比较
如图7蓝色线所示,在相对湿度74%-92%的环境中,最初的高湿度可能促进了霉菌的生长,就像在其他环境中观察到的一样,而最后几周霉菌生长出现衰退的现象,说明低的相对湿度明显抑制了霉菌的生长(第四周周中后,相对湿度迅速从90%下降到75%(图3))。
在相对湿度94%-99%的环境中,霉菌的生长面积比是三个不同相对湿度环境中的最大者,意味着霉菌生长状况最好(图7黑色线)。在该高湿环境条件下,水分在样品表面冷凝和蒸发相互交替,形成促进了霉菌的生长的液态水和湿润面。这样的相对湿度环境与我国南方地区的土遗址依存环境较为相似——遗址表面附近的空气处于高湿度状态,即使周边环境中微弱的温度波动也会引起遗址表面的交替性冷凝和蒸发,为遗址表面微生物的繁殖创造了有利条件。
如图7中红色线所示,在相对湿度大于99.9%的环境中,极高的湿度抑制了霉菌的生长。霉菌生长面积比远低于相对湿度94%-99%的环境,多数时间甚至低于相对湿度74%-92%的环境。这意味着,在相对湿度大于99.9%的条件下,过量的水分可能会在样品表面形成水膜,切断氧气供应而抑制霉菌的生长,因为氧气浓度必须大于0.14%-0.25%才能发生霉菌的生长[38]。但是,我们可以观察到,相对湿度大于99.9%的黑暗组在最后三周中的平均霉菌生长面积比仍增加到25%(图7)。我们推测可能是由于蒸发而引起的水膜间歇性消失造成了霉菌的生长,即发生了类似于相对湿度为94%-99%环境中的现象。
因此我们更加关注相对湿度为94%-99%和相对湿度大于99.9%环境的对比。94%-99%的相对湿度已经接近饱和状态(图3b),但该环境中相对湿度处于波动状态,从而使样品表面的水膜间歇性存在,这不仅没有抑制反而有利于霉菌的生长。我们在地下墓葬的研究中也观察到类似的现象[3][33][39],即极高湿环境中未发现霉菌生长,而相对湿度高但波动的位置发现了霉菌的生长。因此,只有极高的湿度并在表面上形成稳定的水膜,才能抑制霉菌生长。
相对湿度的控制在调控土遗址的依存环境时很重要。因为在地下水位较浅的潮湿地区,土遗址受地下水补给往往保持很高的水分含量,其表面附近的空气相对湿度也很高[40]。在这种情况下,很难降低土遗址的含水量和附近空气的相对湿度。我们的实验结果得出,较低的相对湿度的环境(74%-92%),或形成有稳定水膜的高湿度环境(相对湿度大于99.9%),都能降低霉菌生长水平。因此,与其将相对湿度保持在75%以下,将相对湿度提升到极高的水平并形成稳定水膜可能会更容易和有效地抑制霉菌生长。
5. 结果
本研究旨在通过实验,探索极高湿度环境下土遗址表面的霉菌生长规律,主要结论如下:
(1)在低湿度环境中(相对湿度74%-92%)样品表面霉菌的生长受到抑制,生长速度缓慢;此外,霉菌在相对湿度低于75%甚至不会生长。因此,将空气相对湿度保持在75%以下来进行遗址的保护是相对安全和有效的方法。
(2)有稳定水膜形成的极高湿度环境(相对湿度大于99.9%)对土遗址潮湿表面的霉菌生长具有明显的抑制作用。因此,在实际的遗址场地中,如果很难降低遗址表面的湿度,反之将空气相对湿度升高至极高水平(相对湿度大于99.9%)并使表面形成稳定的水膜可能是遗产保护的另一种选择。
(3)值得注意的是,相对湿度存在波动的高湿环境(相对湿度94%-99%)有利于霉菌的生长,并在样品的潮湿表面可以观察到大量的霉菌繁殖。这意味着我们在遗产保护中,应该尽可能地避免土遗址本体周边的相对湿度维持在此区间内,进而通过环境调控措施将相对湿度保持在75%以下,或相对湿度大于99.9%、形成有稳定水膜的高湿度环境。
参考文献
[1].F. Stomeo, M.C. Portillo, J.M. Gonzalez, L. Laiz, C. Saiz-Jimenez, Pseudonocardia in white colonizations in two caves with Paleolithic paintings, Int. Biodeterior. Biodegrad. 62 (2008) 483–486.
[2].L. Krakova, F. De Leo, L. Bruno, D. Pangallo, C. Urzì, Complex bacterial diversity in the white biofilms of the Catacombs of St. Callixtus in Rome evidenced by different investigation strategies, Environ. Microbiol. 17 (2015) 1738–1752.
[3].J. Sugiyama, T. Kiyuna, K.D. An, Y. Nagatsuka, Y. Handa, N. Tazato, J. Hata-Tomita, M. Nishijima, T. Koide, Y. Yaguchi, Microbiological survey of the stone chambers of Takamatsuzuka and Kitora tumuli, Nara Prefecture, Japan: a milestone in elucidating the cause of biodeterioration of mural paintings, Proc. 31st Int. Symp. Conserv. Restor. Cult. Prop. Study Environ. Cond. Surrouding Cult. Prop. Their Prot. Meas. (2008) 51–73.
[4].T. Kiyuna, K.D. An, R. Kigawa, C. Sano, S. Miura, J. Sugiyama, Molecular assessment of fungi in “black spots” that deface murals in the Takamatsuzuka and Kitora Tumuli in Japan: Acremonium sect. Gliomastix including Acremonium tumulicola sp. nov. and Acremonium felinum comb. nov, Mycoscience. (2011).
[5].C. Tonon, S.E. Favero-Longo, E. Matteucci, R. Piervittori, P. Croveri, L. Appolonia, V. Meirano, M. Serino, D. Elia, Microenvironmental features drive the distribution of lichens in the House of the Ancient Hunt, Pompeii, Italy, Int. Biodeterior. Biodegrad. 136 (2019) 71–81.
[6].Ž. Savković, N. Unković, M. Stupar, M. Franković, M. Jovanović, S. Erić, K. Šarić, S. Stanković, I. Dimkić, J. Vukojević, M. Ljaljević Grbić, Diversity and biodeteriorative potential of fungal dwellers on ancient stone stela, Int. Biodeterior. Biodegrad. 115 (2016) 212–223.
[7].J.S. Kiurski, J.G. Ranogajec, A.L. Ujhelji, M.M. Radeka, M.T. Bokorov, Evaluation of the effect of lichens on ceramic roofing tiles by scanning electron microscopy and energy-dispersive spectroscopy analyses, Scanning. 27 (2005) 113–119.
[8].M. Radeka, J. Kiurski, S. Markov, R. Marinkovi-Neduin, J. Ranogajec, Microbial deterioration of clay roofing tiles, in: WIT Trans. Built Environ., 2007: pp. 567–575.
[9].P. Albertano, L. Bruno, S. Bellezza, G. Paradossi, Polysaccharides as a key step in stone bio-erosion, in: Proc. 9th Int. Congr. Deterior. Conserv. Stone, Elsevier, 2000: pp. 425–432.
[10].M.L. Suihko, H.L. Alakomi, A. Gorbushina, I. Fortune, J. Marquardt, M. Saarela, Characterization of aerobic bacterial and fungal microbiota on surfaces of historic Scottish monuments, Syst. Appl. Microbiol. 30 (2007) 494–508.
[11].J.A. Larbi, Microscopy applied to the diagnosis of the deterioration of brick masonry, Constr. Build. Mater. 18 (2004) 299–307.
[12].J. Ranogajec, S. Radosavljević, R. Marinković-Nedućin, B. Živanović, Chemical corrosion phenomena of roofing tiles, Ceram. Int. 23 (1997) 99–103.
[13].R.A. Kühnel, Cause and consequence: volume changes behind building material deterioration, Mater. Charact. 53 (2004) 171–180.
[14].T. Li, Y. Hu, B. Zhang, X. Yang, Role of Fungi in the Formation of Patinas on Feilaifeng Limestone, China, Microb. Ecol. 76 (2018) 352–361.
[15].A.A. Gorbushina, Life on the rocks, Environ. Microbiol. 9 (2007) 1613–1631.
[16].B. Prakash, B.M. Veeregowda, G. Krishnappa, Biofilms: A survival strategy of bacteria, Curr. Sci. 85 (2003) 1299–1307.
[17].Qi-Wang, G.Y. Ma, L.Y. He, X.F. Sheng, Characterization of bacterial community inhabiting the surfaces of weathered bricks of Nanjing Ming city walls, Sci. Total Environ. 409 (2011) 756–762.
[18].F. Bartoli, A.C. Municchia, Y. Futagami, H. Kashiwadani, K.H. Moon, G. Caneva, Biological colonization patterns on the ruins of Angkor temples (Cambodia) in the biodeterioration vs bioprotection debate, Int. Biodeterior. Biodegrad. 96 (2014) 157–165.
[19].S. Mandal, J. Rath, Algal colonization and its ecophysiology on the fine sculptures of terracotta monuments of Bishnupur, West Bengal, India, Int. Biodeterior. Biodegrad. 84 (2013) 291–299.
[20].R.J. Palmer, P. Hirsch, Photosynthesis‐based microbial communities on two churches in northern Germany: Weathering of granite and glazed brick, Geomicrobiol. J. 9 (1991) 103–118.
[21].H. Viitanen, J. Vinha, K. Salminen, T. Ojanen, R. Peuhkuri, L. Paajanen, K. Lähdesmäki, Moisture and Bio-deterioration Risk of Building Materials and Structures, J. Build. Phys. 33 (2010) 201–224.
[22].A. Hyvärinen, T. Meklin, A. Vepsäläinen, A. Nevalainen, Fungi and actinobacteria in moisture-damaged building materials - Concentrations and diversity, Int. Biodeterior. Biodegrad. 49 (2002) 27–37.
[23].H. Hens, IEA Annex 14: Condensation and Energy, J. Therm. Envel. Build. Sci. 15 (1992) 261–273.
[24].E. Vereecken, S. Roels, Review of mould prediction models and their influence on mould risk evaluation, Build. Environ. 51 (2012) 296–310.
[25].C. Grant, C.A. Hunter, B. Flannigan, A.F. Bravery, The moisture requirements of moulds isolated from domestic dwellings, Int. Biodeterior. 25 (1989) 259–284.
[26].S.L. Smith, S.T. Hill, Influence of temperature and water activity on germination and growth of Aspergillus restrictus and A. versicolor, Trans. Br. Mycol. Soc. 79 (1982) 558–560.
[27].K.F. Nielsen, G. Holm, L.P. Uttrup, P.A. Nielsen, Mould growth on building materials under low water activities. Influence of humidity and temperature on fungal growth and secondary metabolism, Int. Biodeterior. Biodegrad. 54 (2004) 325–336.
[28].M. Stomp, J. Huisman, F. De Jongh, A.J. Veraart, D. Gerla, M. Rijkeboer, B.W. Ibelings, U.I.A. Wollenzien, L.J. Stal, Adaptive divergence in pigment composition promotes phytoplankton biodiversity, Nature. 432 (2004) 104–107.
[29].Y. Li, H. Xie, D. Ogura, S. Hu, Q. Guo, Quantitative analysis of mold growth differences on surfaces in damp soil ruins affected by ventilation and lighting modes: Soil ruin exhibition halls in high-humidity regions, J. Asian Archit. Build. Eng. 15 (2016) 133–138.
[30].A. Cheng, Y. Hsin, W.T. Lin, Effects of mold growth on building materials by different environments in Taiwan, KSCE J. Civ. Eng. 18 (2014) 1083–1090.
[31].G.H. dos Santos, N. Mendes, P.C. Philippi, A building corner model for hygrothermal performance and mould growth risk analyses, Int. J. Heat Mass Transf. 52 (2009) 4862–4872.
[32].C. Schabereiter-Gurtner, C. Saiz-Jimenez, G. Piñar, W. Lubitz, S. Rölleke, Phylogenetic diversity of bacteria associated with Paleolithic paintings and surrounding rock walls in two Spanish caves (Llonín and La Garma), FEMS Microbiol. Ecol. 47 (2004) 235–247.
[33].Z. Huang, F. Zhao, Y. Li, J. Zhang, Y. Feng, Variations in the bacterial community compositions at different sites in the tomb of Emperor Yang of the Sui Dynasty, Microbiol. Res. 196 (2017) 26–33.
[34].B.W. Held, J.A. Jurgens, B.E. Arenz, S.M. Duncan, R.L. Farrell, R.A. Blanchette, Environmental factors influencing microbial growth inside the historic expedition huts of Ross Island, Antarctica, Int. Biodeterior. Biodegrad. 55 (2005) 45–53.
[35].O.C.G. Adan, H.P. Huinink, M. Bekker, Water relations of fungi in indoor environments, in: Fundam. Mold Growth Indoor Environ. Strateg. Heal. Living, Wageningen Academic Publishers, Wageningen, 2011: pp. 41–65.
[36].W.J. Scott, Water Relations of Food Spoilage Microorganisms, Adv. Food Res. 7 (1957) 83–127.
[37].T. Ojanen, H. Viitanen, R. Peuhkuri, K. Lähdesmäki, J. Vinha, K. Salminen, Mold growth modeling of building structures using sensitivity classes of materials, in: Therm. Perform. Exter. Envel. Whole Build. - 11th Int. Conf., 2010.
[38].K. Sedlbauer, Prediction of mould fungus formation on the surface of/and inside building components, (2001) 247.
[39].M. Khalil, T. Ishizaki, Moisture characteristic curves of tuff breccia stone, Hozon Kagaku. (2008) 11–19.
[40].S. Wakiya, N. Kuwabara, S. Hokoi, D. Ogura, Deterioration of Remains Exhibited in the Excavation Site Exhibition Hall, Heijyo-Kyu Palace Site, Adv. Mater. Res. 1126 (2015) 39–52.